2024年3月8日,88858cc永利官网生物化學與分子生物學系研究生趙雪楓同學和團隊成員在國際著名期刊The Journal of Biological Chemistry(Nature指數期刊、美國生物化學與分子生物學學會會刊)發表題為“去泛素化酶 OTUB1 通過穩定 YTHDF2 蛋白介導PRSS8 mRNA 降解促進前列腺癌細胞增殖”(YTHDF2 protein stabilization by the deubiquitinase OTUB1 promotes prostate cancer cell proliferation via PRSS8 mRNA degradation) 的研究論文,揭示了OTUB1調控YTHDF2蛋白穩定性介導PRSS8 mRNA 降解參與前列腺癌進展的新機制。

前列腺癌是男性泌尿系統最常見的惡性腫瘤之一,我國前列腺癌的發病率與病死率呈逐年上升趨勢。m6A是RNA甲基腺嘌呤上發生的甲基化修飾,多種惡性腫瘤的發生發展與異常的m6A修飾密切相關。YTHDF2作為最早發現的m6A修飾閱讀蛋白,主要介導m6A mRNA的穩定性,也是潛在的腫瘤治療靶點。在RNA處理方面,YTHDF2通過C端識别結合m6A mRNA,而其N端則招募多種調控mRNA穩定性的蛋白複合物,啟動不同的mRNA處理途徑。在蛋白修飾方面,YTHDF2上可發生泛素化、SUMO化、磷酸化等多種翻譯後修飾,這些修飾給予YTHDF2更多的功能複雜性。雖然YTHDF2在多種腫瘤中異常高表達,但是其機制及功能仍待進一步探究。
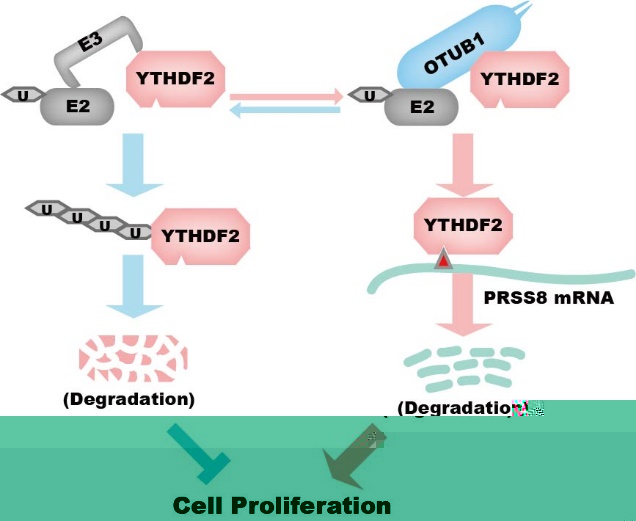
趙雪楓同學所在團隊長期緻力于表觀遺傳修飾相關蛋白質在腫瘤中的生物學功能研究。在該研究中,趙雪楓同學等人通過生物信息學分析、體内和體外生化實驗和增殖表型檢測揭示了YTHDF2在前列腺癌中的功能與作用機制。該研究首先通過分析質譜數據與Co-IP實驗篩選出與YTHDF2可能互作的蛋白,結果顯示在前列腺癌中YTHDF2與OTUB1有互作。又通過蛋白穩定性檢測及一系列體内和體外泛素化與去泛素化反應,發現OTUB1是YTHDF2的新的去泛素化酶,但是OTUB1不是直接去除YTHDF2上的泛素化,而是通過非經典途徑,即抑制E2與底物結合,從而抑制YTHDF2的泛素化。在功能方面,作者通過基因表達操作和一系列細胞增殖實驗,證明OTUB1通過增加YTHDF2的蛋白穩定性促進前列腺癌細胞增殖表型。作者又通過生信與meRIP測序數據分析,篩選可能的YTHDF2下遊基因,并通過基因表達操作、RIP和meRIP等實驗鑒定出YTHDF2的下遊靶标PRSS8。接下來,作者通過細胞增殖實驗及臨床樣本驗證發現PRSS8 抑制前列腺癌細胞的增殖表型。作者還進一步通過生信分析和細胞亞定位相關實驗發現E-Cadherin/β-Catenin與 PRSS8 的表達相關,在功能上,PRSS8 能促進前列腺癌細胞的上皮形态轉化,增加質膜上的 E-Cadherin定位,降低細胞核中的β-Catenin定位,從而抑制細胞惡性表型。最後,作者通過基因表達操作和一系列細胞增殖實驗,進一步驗證PRSS8 是 OTUB1-YTHDF2 調節軸的一個關鍵因子。綜上所述,該研究揭示了OTUB1-YTHDF2-PRSS8調控軸在前列腺癌中的作用機理,OTUB1與YTHDF2互作并抑制其泛素化降解,從而影響下遊抑癌靶标PRSS8 mRNA穩定性,進而促進前列腺癌細胞增殖。此研究深化了對YTHDF2在前列腺癌中作用機制的理解,對于開發針對YTHDF2的前列腺癌治療途徑提供了新的策略。
生物化學與分子生物學系研究生趙雪楓為該論文的第一作者,趙雪楓同學在讀期間多次獲得“華中科技大學知行優秀獎學金”、“紅安惠農博士生獎學金”、“華中科技大學三好研究生”等榮譽。生物化學與分子生物學系宋檀婧和孫立棟老師為該論文的共同通訊作者。該研究得到了國家自然科學基金的支持。
 學院官方微信
學院官方微信