
生物大分子,如蛋白質等,可以通過相分離形成無膜凝聚體,這些凝聚體在細胞内起着非常重要的作用,如傳遞細胞信号、形成細胞器、調控基因轉錄等。然而,一個關鍵的問題是:信号蛋白能否通過形成凝聚體來抵抗蛋白酶體的降解,從而變得更穩定,并更持久地發揮其生物學功能?
2024年1月10日,華中科技大學88858cc永利官网孫書國教授團隊在《Nature Chemical Biology》期刊上發表題為“LATS2 condensates organize signalosomes for Hippo pathway signal transduction”的研究論文。該研究發現在細胞脫附(detachment)引發的F-actin胞質骨架重組的過程中,Hippo信号通路核心蛋白激酶LATS2從黏着連接上釋放并在胞漿中形成凝聚體,該凝聚體招募Hippo信号通路中的重要組分形成Hippo信号體,促進Hippo信号通路的激活、YAP的失活和細胞的失巢凋亡;同時,LATS2通過凝聚體的形成,以物理區隔的方式使其避免E3連接酶 FBXL16引起的泛素化依賴的降解,因此變得更穩定。相反, 在惡性腫瘤中, FBXL16的擴增抑制了LATS2的凝聚體的形成進而導緻細胞失巢凋亡抵抗和腫瘤的進展。
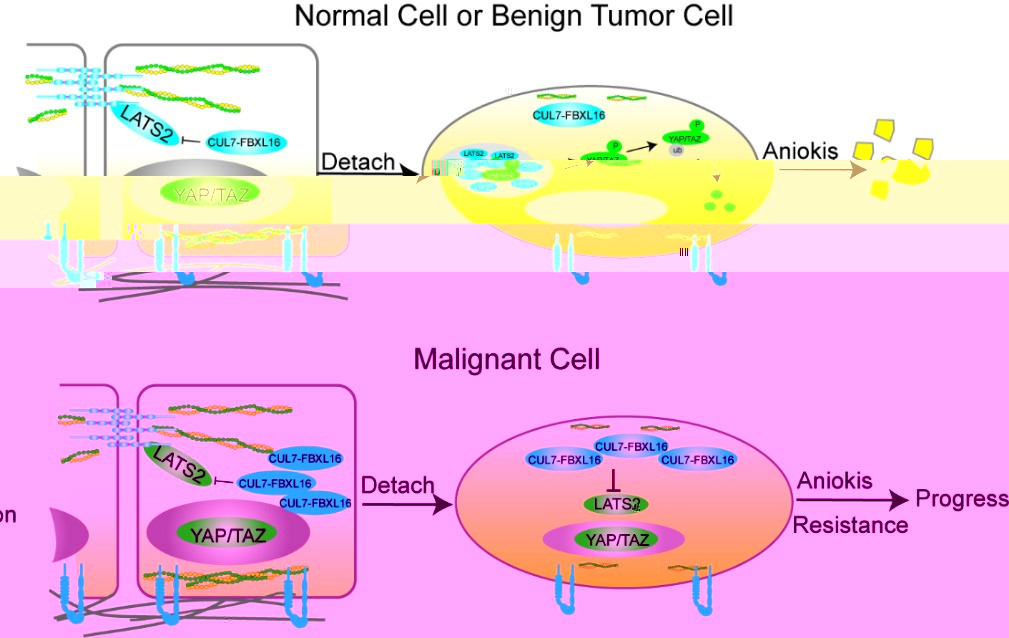
圖: LATS2蛋白凝聚體招募Hippo信号體介導YAP/TAZ失活并促進腫瘤進展的模式圖
高度保守的Hippo信号通路在許多生物學過程中扮演着重要角色,如器官尺寸控制,腫瘤的發生、發展和耐藥等。該信号通路不僅可以響應生化信号,還能感知機械力和胞質骨架的變化。然而,胞質骨架如何調節Hippo信号通路,以及核心激酶LATS1/2在這個過程中的定位和動态變化,尚未被完全闡明。本研究發現,當細胞脫附和胞質骨架發生重組時,原本在細胞黏着連接上分布的LATS2蛋白會脫離并在胞漿中呈顆粒狀分布,形成相分離凝聚體,且伴随LATS2蛋白水平顯著增加和YAP完全失活。有趣的是,即使表達隻有相分離能力而失去了激酶結構域的LATS2N片段(1-667氨基酸),YAP也能被完全失活,這和傳統的去掉激酶結構域後出現顯性負抑制(Dominant Negative)效應相反。原因是LATS2N形成的凝聚體招募了内源的LATS2導緻了YAP的失活,且伴随内源的LATS2的蛋白水平上升。以上研究表明,當内源的LATS2以凝聚體的形式組織時比均勻分布活性更強,同時蛋白更穩定,提示凝聚體可以保護蛋白不被蛋白酶體降解。通過篩選,本研究鑒定到E3泛素連接酶FBXL16可以泛素化降解LATS2,且發現在侵襲性乳腺癌組織中存在FBXL16的高頻擴增并與YAP上調呈現正相關,提示其在癌症中的關鍵作用。進一步研究結果證明FBXL16上調極大地抑制了LATS2蛋白凝聚體的形成進而促進細胞失巢凋亡抵抗和腫瘤的進展。總的來說,這項研究揭示了LATS2如何通過形成凝聚體來穩定自身并促進Hippo信号通路的激活。這為理解細胞信号轉導和癌症發生、發展提供了新的視角。
論文第一完成單位為華中科技大學88858cc永利官网,孫書國教授為本文的通訊作者,華中科技大學88858cc永利官网博士生秦敏為第一作者。
 學院官方微信
學院官方微信