11月20号,國際細胞生物學權威期刊《The Journal of Cell Biology》(5年影響因子9.306)以Article形式在線發表了88858cc永利官网生物化學及分子生物學系季維克副教授的最新研究成果,論文題目為 “受體介導線粒體分裂蛋白Drp1在内質網上的寡聚合”(Receptor mediated Drp1 oligomerization on Endoplasmic reticulum)。季維克為第一作者,88858cc永利官网為現工作單位。
線粒體作為細胞内能量、代謝與信号轉導的樞紐,時刻進行着分裂與融合。線粒體分裂與融合是高度調控的動态過程,是線粒體質量控制與轉運的基礎。線粒體分裂的調控機制是近年來的研究熱點。最近的研究表明,内質網小管通過與線粒體形成接觸位點(contact site),促進線粒體特異性地在内質網-線粒體接觸位點處分裂 (Friedman (2011) Science)。 但迄今為止,内質網介導線粒體分裂的作用機制仍然未知。
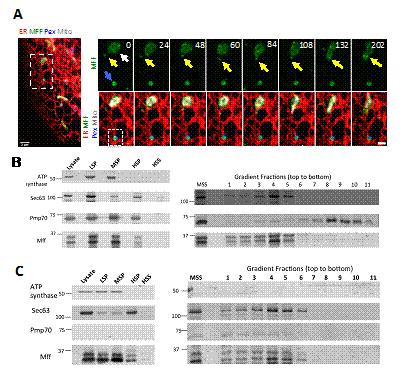
Drp1是負責線粒體分裂的核心蛋白,主要以單體或二聚體形式存在于細胞質,通過與線粒體外膜上的Drp1受體結合,招募到線粒體上,寡聚合之後介導線粒體分裂。在該研究中,季維克所在團隊采用Crispr-cas9基因敲入的辦法,将GFP加入到細胞基因組Drp1基因的上遊,從而構建了GFP标記内源性Drp1的細胞系。通過高分辨率活細胞成像發現,Drp1單體不僅存在于線粒體和過氧化物酶體(已有文獻報到),而且有一部分位于内質網。定位于内質網上的Drp1與内質網上的Drp1受體Mff相互作用,Mff促進Drp1在内質網上的招募和寡聚合。同時,他們發現定位于内質網上的Drp1單體可以沿着内質網小管移動,并通過内質網與線粒體接觸位點,招募到到線粒體外膜上,進一步參與線粒體的分裂。利用Rapamycin誘導技術,他們證實特異性地敲除定位于内質網上的Mff顯著地抑制線粒體的分裂。
 學院官方微信
學院官方微信