5月13日,國際知名雜志EMBO Rep(影響因子8.749)在線刊發了88858cc永利官网病理生理學系劉恭平教授、王建枝教授團隊研究成果:Tau accumulation triggers STAT1-dependent memory deficits by suppressing NMDA receptor expression.
阿爾茨海默病(Alzheimer’s disease,AD)是老年人中最常見的神經系統退行性疾病,現今無有效的診斷與治療手段。AD典型的病理學特征之一是Tau蛋白異常聚集形成的神經原纖維纏結。大量研究表明Tau蛋白異常聚集可以誘發突觸毒性,但其分子機制并不清楚。王建枝、劉恭平教授團隊在過表達人全長tau(hTau)蛋白的細胞中,發現520種mRNA水平有顯著性變化;同時在轉錄因子活性篩查中發現STAT1轉錄活性顯著上調。于hTau轉基因鼠、過表達AAV-hTau病毒小鼠及AD患者腦組織均發現STAT1的激活;而STAT1的條件性敲除能顯著性逆轉hTau誘發突觸相關蛋白NMDARs的轉錄抑制和學習記憶障礙。染色質免疫共沉澱發現STAT1能直接結合NMDARs啟動子區;熒光素報告基因發現STAT1對NMDARs有轉錄抑制作用;并發現hTau聚積可激活JAK2,而後者介導了STAT1的磷酸化水平升高與活化。使用STAT1-Y701F失活突變病毒可抑制STAT1激活,逆轉hTau誘發的突觸毒性作用。該研究發現了htau聚積通過激活JAK2-STAT1通路,抑制NMDARs轉錄,從而使突觸可塑性下降,導緻學習記憶損傷。這一研究結果揭示了AD新的發病機制,可望為AD藥物開發提供新的靶标。
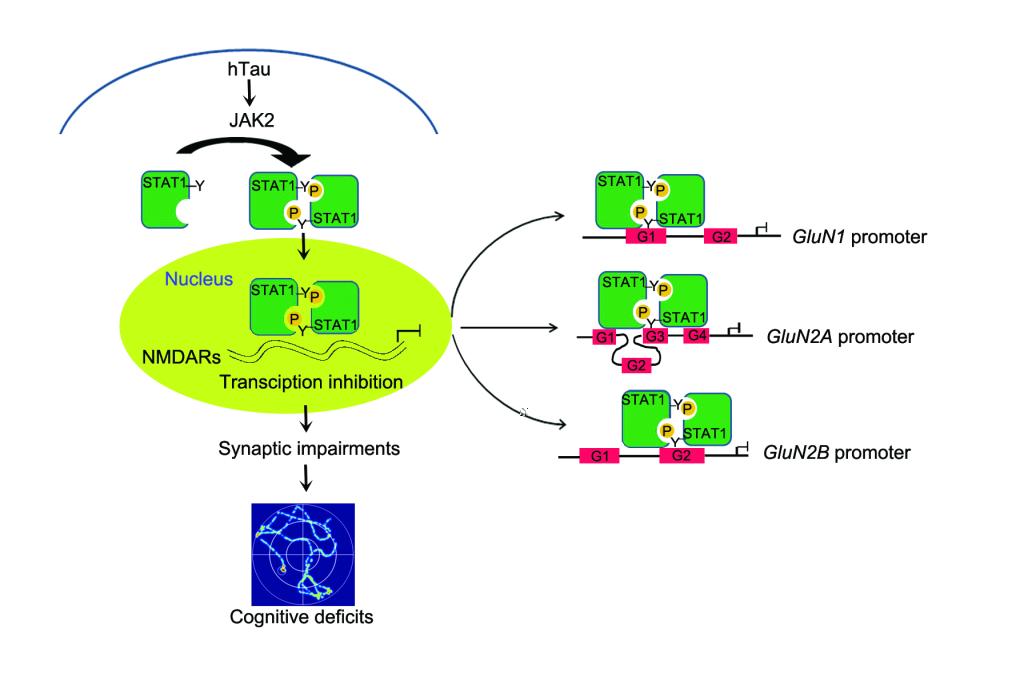
該研究由博士研究生李曉光、洪小月等共同完成。李曉光(王建枝教授2012級直博生)、洪小月(劉恭平教授2016級博士生)為該文的共同第一作者,劉恭平教授、王建枝教授為共同通訊作者,華中科技大學為第一發表單位。該課題受到國家自然科學基金面上項目、重點項目以及科技部國家重點研發計劃慢病專項等資助。
文章在線鍊接:
http://embor.embopress.org/content/early/2019/05/13/embr.201847202.long
 學院官方微信
學院官方微信