1月25日,自噬研究領域國際知名雜志Autophagy(2018年影響因子11.1)在線刊發了88858cc永利官网免疫學系楊想平教授團隊研究成果:The macrophage-specific V-ATPase subunitATP6V0d2 restricts inflammasome activation and bacterial infection byfacilitating autophagosome-lysosome fusion。
自噬不僅是真核細胞重要的營養補給途徑,同時還能清除壞死細胞器,抑制炎症以及抵抗細菌感染。臨床 上,ATG16L1和IRGM的基因突變與克羅恩病等自身免疫性疾病發生密切相關。Atg16l、Atg5或Atg7等參與自噬的關鍵基因缺失導緻小鼠腸炎炎症反應明顯增強。深入研究自噬調節炎症性疾病的分子機制具有重要臨床意義。
盡管對自噬的分子機制研究非常深入,但關于自噬的關鍵步驟自噬體與溶酶體融合的分子機制并不十分清楚。楊想平教授課題組在分析巨噬細胞轉錄組數據時,發現LPS刺激能顯著下調巨噬細胞特異表達的溶酶體膜蛋白ATP6V0d2。與預測相反,ATP6V0d2并不影響溶酶體酸化及其所含蛋白水解酶成熟與活化,但與之相似的另一分子,ATP6V0d1為溶酶體正常酸化所必需。當給予小鼠尾靜脈注射LPS誘導内毒素模型以及口服DSS構建腸炎模型時,Atp6v0d2-/-小鼠炎症病理表型更加嚴重,該表型可被抗IL-1β中和抗體所逆轉。體外細胞實驗發現,Atp6v0d2-/-BMDM在不同炎症小體激動劑刺激後,炎症小體活化程度明顯強于野生型BMDM。進一步實驗發現,Atp6V0d2缺失的BMDM中損傷線粒體積累更多,自噬體數目增多,自噬體生成無差異但自噬體和溶酶體融合受阻。
其機制為:ATP6V0d2通過促進自噬體上STX17與溶酶體上VAMP8結合來介導自噬體溶酶體融合。并且Atp6V0d2缺失的BMDM清除沙門氏杆菌細菌的能力減弱,敲除了Atp6V0d2的小鼠感染細菌後存活時間明顯縮短,同時在腸組織和脾髒等淋巴器官中檢測到更多的細菌侵襲,表明ATP6V0d2介導的融合能有效清除細菌感染。
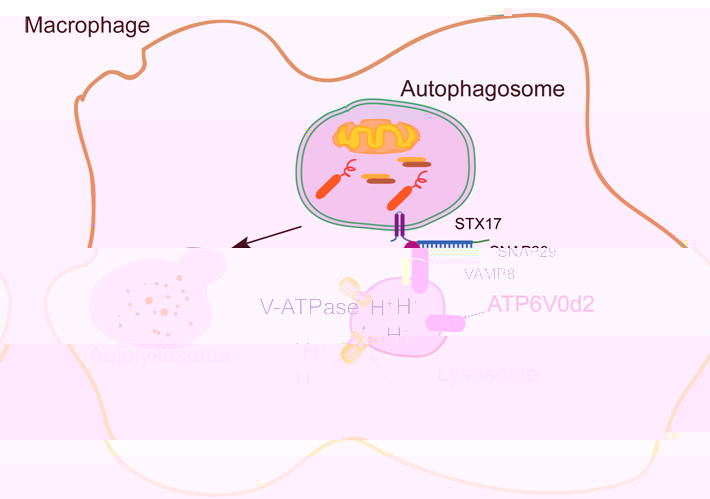
該研究發現了巨噬細胞特異的自噬溶酶體融合機制:特異性高表達于巨噬細胞的溶酶體蛋白ATP6V0d2介導其自噬溶酶體融合。這一機制可望為臨床通過調控自噬幹預治療炎症性及感染性疾病提供新的思路和策略。
該研究由博士研究生夏宇、劉娜,以及碩士研究生謝秀秀、畢國宇等共同完成。夏宇(2015級博士研究生)為該文第一作者,楊想平教授為獨立通訊作者,華中科技大學為第一發表單位。該課題受到國家自然科學基金面上項目以及華中科技大學交叉培育項目資助。
文章在線鍊接:
https://www.tandfonline.com/doi/full/10.1080/15548627.2019.1569916

 學院官方微信
學院官方微信
